5年内所有血液肿瘤都能被细胞疗法治愈,未来所有肿瘤都能被CAR-T细胞疗法治愈。
时光回溯到十年前。2011年,Carl June的团队用CAR-T(英文全称Chimeric Antigen Receptor T-Cell Immunotherapy)细胞疗法成功治愈了一名急性白血病复发的小女孩艾米丽,成为世界首例通过该疗法治愈癌症的临床病人,堪称医学界的奇迹。CAR-T疗法也第一次进入大众的视野。
什么是CAR-T?
我们把CAR-T拆开来解读。T即T淋巴细胞,在人体内扮演着“战士”的角色。它是人体白细胞的一种,主要工作任务就是抵御和消灭感染、肿瘤、外来异物等“敌人”。关注过艾滋病的人可能会对T细胞比较熟悉。艾滋病之所以如此可怕,就在于HIV病毒会大量攻击、破坏人体免疫系统中的CD4+T细胞,从而使人丧失免疫功能,也就让艾滋病患者在各种感染和疾病面前不堪一击。
CAR,中文学名“嵌合抗原受体”,发挥着类似定位导航的作用。实验室中,技术人员通过基因工程技术,将T细胞激活,并装上“定位导航装置”CAR,将T细胞这个普通“战士”改造成“超级战士”。CAR-T这个超级战士利用其定位导航装置CAR,专门识别体内肿瘤细胞,并通过免疫作用释放多种效应因子,高效地杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。
细胞免疫治疗技术是一种复杂的医疗技术,细胞提取、扩增、回输说来简单,但实际上每一步都需要严格的质量控制,并且每位患者的情况不同要采用不同细胞,不同的输注剂量和不同的治疗方案,可以说是“千人千面”,是真正的个性化治疗手段。
2017年,Carl June获得美国临床肿瘤学会(ASCO)年会上最重要、最具分量的戴维·卡尔诺夫斯基纪念奖,也正是在那一年,两款CAR-T产品现在被FDA批准上市。
中美研发势头强劲
2017年吉利德Yescarta®以及诺华Kymriah®先后上市,至此开启了全球范围内CAR-T临床开发的爆发式增长。2019年这两款药物全年收入分别为4.56亿美元和2.78亿美元。有机构预测至2025年,CAR-T市场规模可达到67.75亿美元。
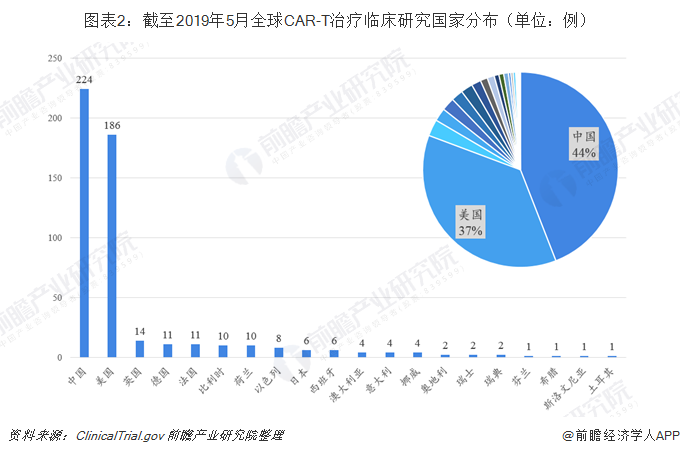
截至2019年5月,全球CAR-T治疗临床试验登记项目507项,主要分布在中国和美国,欧洲、日本和南半球的临床试验数量要少得多。这与接受和投资新兴疗法的意愿、卫生监管政策以及社会差异都相关。具体来看,中国以224例CAR-T治疗临床试验居于全球首位,美国以186例位居第二,两国分别占全球试验总数的44%和37%。
目前,国内进度最快的复星凯特CAR-T产品益基利仑赛注射液已经在今年2月提交上市申请,该款药物为复星凯特从Kite Pharma(后被吉列德收购)引进的已上市产品Yescarta®。而南京传奇/杨森、药明巨诺、恒润达生、科济制药、西比曼、优卡迪等多家中国生物医药公司开发的CAR-T疗法也获得了令人惊艳的数据。
监管政策存在争议,评价体系尚不完善
目前,我国针对细胞核基因治疗产品按照医疗技术还是药品来管理存在争议。现阶段采取类似日本的“双轨制”监管模式:药品可经过CDE由药品研发和审批途径上市;针对医疗机构的临床研究则需向卫健委备案。这种模式在客观上提升了我国细胞治疗技术临床开发的速度,这点也被业内人士认为是我国与美国相比的一大优势,但与日本相比,依然存在三个主要问题:
1、 法律监管力度不足。目前的监管文件均已办法、指南、原则为主,没有到立法阶段,且缺乏可操作性,容易在临床转化过程中产生混乱。
2、 缺少指南、技术评价等规范性文件,导致行业研究水平缺少评价标准,研究水平良莠不齐。魏则西事件就是一个惨痛的教训。
新靶点、异体、联合疗法成为研发趋势
CAR-T疗法虽然眼下研发势头火热,但也有着其局限性,成为限制整个行业发展的因素。
首先,目前在开发靶点中,全球约有一半的CAR-T细胞靶点均为CD19,国内针对CD19的CAR-T品种多达50余个,其中进展最快的是国外已上市的Yescarta®。CD19靶点在B细胞恶性肿瘤中的重量级地位已然是无可撼动,以CD19为靶点的CAR-T疗法更是业界公认的B细胞恶性肿瘤的完美解决方案。此外,在多发性骨髓瘤(MM)领域中,BCMA(B cell maturation antigen)靶点受到青睐,而除此之外的靶点却较少有进入临床。
第二,大多数CAR-T细胞都是利用患者自身的T细胞来产生,由于患者个体间的差异,定制T细胞昂贵且费时,当前主流的自体CAR-T疗法由于抗原特异性而使得应用受限。
第三,和血液肿瘤相比,CAR-T疗法在实体瘤方面遇到的问题更为棘手。一方面,实体瘤发生部位不像血液系统散布全身,CAR-T细胞需抵达实体瘤病灶,并浸润到肿瘤内部;另一方面,即使CAR-T细胞能够浸润到实体瘤内部,也会面临其内部免疫微环境的抑制,影响T细胞正常发挥作用。此外,实体瘤内部微环境存在偏酸、缺氧及营养缺乏等情况,也不利于CAR-T细胞发挥作用。
正因为自体CAR-T有着诸多限制,不利于企业商业化盈利,科学家们致力于开发通用型CAR-T(UCAR-T)技术,采用健康捐献者的血液解决自体CAR-T的局限性实现批量生产,降低成本,并通过CRISPER/Cas9等基因编辑技术,进一步增强CAR-T细胞功能。目前比较领先的企业有Cellectis、Allogene、Precision、Celyad等不超过十家。
B村客官亘喜正在在UCAR-T技术上潜心研发。今年4月,其研发的GC007g注射液获批进入临床,成为国内首个获得临床批件的异体CAR-T产品;另一位客官克睿基因,利用CRISPER/Cas9基因编辑技术,加强免疫细胞治疗效果,其针对肿瘤和遗传性疾病两个基因编辑项目预计将在两年内进入临床。此外,B村药明巨诺、博生吉药业均有产品获批进入临床,细胞免疫治疗集群初具规模。
针对除了CD19靶点之外的新靶点也积极探索,近日,全球首个针对CLDN18.2靶点的CAR-T细胞候选药物由科济生物向美国FDA申请并获批,用于胃癌以及胰腺癌。
而CAR-T的联合疗法近些年也颇受研究人员关注,并且在与小分子和抗体药物的联用临床试验中都取得的不错的成绩。
CAR-T+BTK抑制剂:近日举办的15届国际恶性淋巴瘤会议(2019 ICML)上的一项结果,对BTK抑制剂伊布替尼(Imbruvica)无效或不耐受的高危复发/难治性慢性淋巴细胞白血病(CLL)患者可从靶向CD19的CAR-T疗法+伊布替尼中获益。
CAR-T+PD-1抗体:在去年的美国癌症研究学会(AACR)年会上,一款靶向间皮素的新型CAR-T细胞技术,通过 CAR-T细胞疗法联合PD-1抗体治疗,在晚期实体瘤患者中取得了很好的治疗效果,且无一例严重的神经毒性、细胞因子释放综合征及其他重要器官的损伤等发生。
负责该项临床研究的纪念斯隆凯特琳癌症中心主任医生表示:这是CAR-T细胞治疗实体肿瘤的第一个成功案例,充分证明了CAR-T细胞与抗PD-1合使用,可有效治疗实体肿瘤。”这是因为此方法通过引入CAR-T细胞将实体“冷肿瘤”(低免疫反应)转变为“热肿瘤”(高免疫反应),通过阻碍肿瘤细胞免疫检查点,保留细胞高免疫反应(维持细胞为热肿瘤)抑制肿瘤细胞生长。
这类联合疗法可以提高疗效以及避免部分患者产生耐药,同时也弥补CAR-T治疗实体瘤方面的缺陷性,或将为CAR-T发展趋势。
不止于T细胞
除了T细胞,科学家还在不同的免疫细胞中的寻求更好的治疗癌症方法。
NK细胞(英文全称Natural Killer cell)又称自然杀伤细胞,是人体第三类淋巴细胞,其表面缺少T细胞和B细胞的特异性标志如TCR和Smlg,曾称为裸细胞。在人外周血中占淋巴细胞的5%-10%,作为免疫系统的核心部分,是人体内最有价值的先天性免疫细胞。
该领域的权威专家,MD安德森癌症中心的免疫治疗专家Katy Rezvani看来,NK细胞是集功效,安全性和相对易用性为一体理想细胞疗法。
第一,体内起效更快速。NK细胞不需要抗原呈递。T细胞需要将其靶细胞的一些部分“呈现”给其他免疫细胞,以将它们识别为外来细胞,并使T细胞聚集成攻击模式。与T细胞不同,NK细胞直接检测并摧毁受感染和恶性细胞,而不必被激活或“训练”以对癌细胞作出反应。
第二,NK细胞具有更广谱的抗肿瘤作用。由于不需要肿瘤特异性识别,且不会被细胞表面的主要组织相容性复合体(MHC)抑制活性限制。NK细胞不需要任何抗原特异性的引发即可提供治疗性抗癌作用,可以发挥更更广谱的抗癌功效。NK细胞不仅适合作为基因编辑的工程细胞疗法,也适合单独扩增回输。
第三,没有严重的副作用。相比之下,NK细胞对HLA复合物的选择要少得多,因此,使用自体或异体的NK细胞不会产生严重的副作用,也不需要与患者免疫匹配,更容易被临床应用。
尽管NK细胞可以迅速进行防御并直接攻击肿瘤细胞,但是人体内该种细胞数量较少,仅占白细胞的10%。并且研究发现,人类到了25岁以后,免疫力下降,NK细胞数量变得更少,肿瘤患者及肿瘤术后患者体内NK细胞的数量及活性都发生了一定的改变,不能非常有效地发挥抗癌作用。并且体外增殖能力很弱,即使获得了一定数目的NK细胞,其活性也会随着时间的流逝而失去,所以要想获得高数量且活性强的NK细胞是一件非常困难的事情。
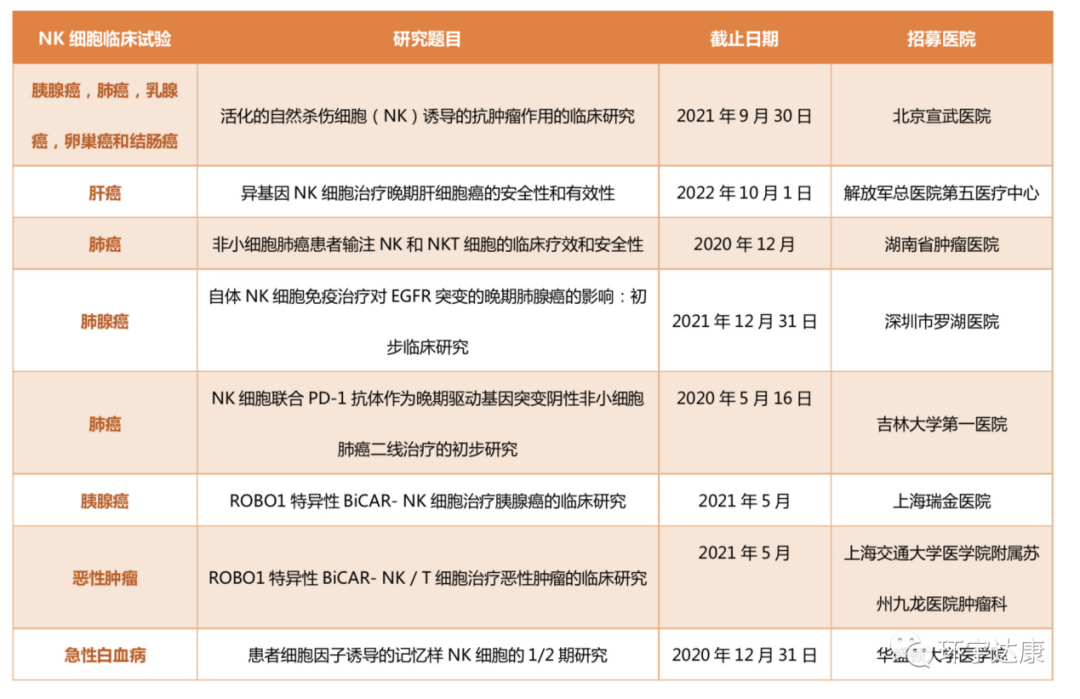
目前,中国和美国NK细胞尚未批准进入临床使用,但都在积极开展NK细胞治疗实体瘤的临床试验。部分中国临床试验:
目前虽然细胞免疫治疗已经取得的一些成绩,但更多仍处于临床探索阶段,有许多障碍有待攻克,在商业化上也远未达到它的“近亲”——免疫检查点抑制剂的百亿美元销售量。但我们依然充满希望,最后还是以Carl H. June的一句话来结束:
来源:BioBAY